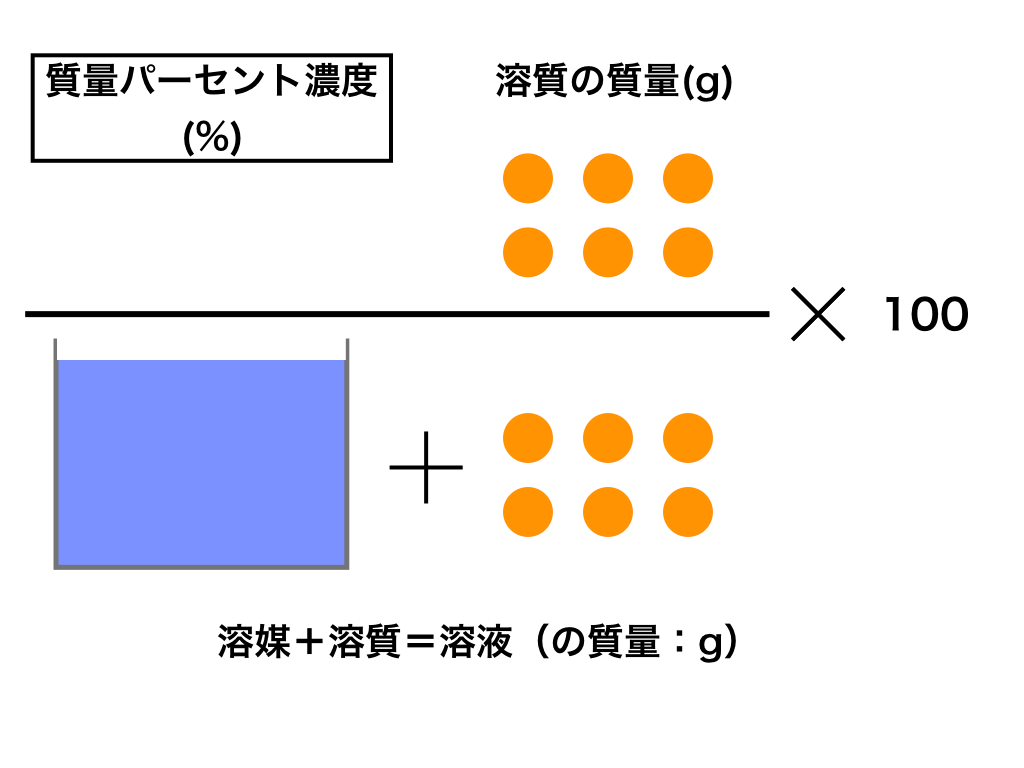
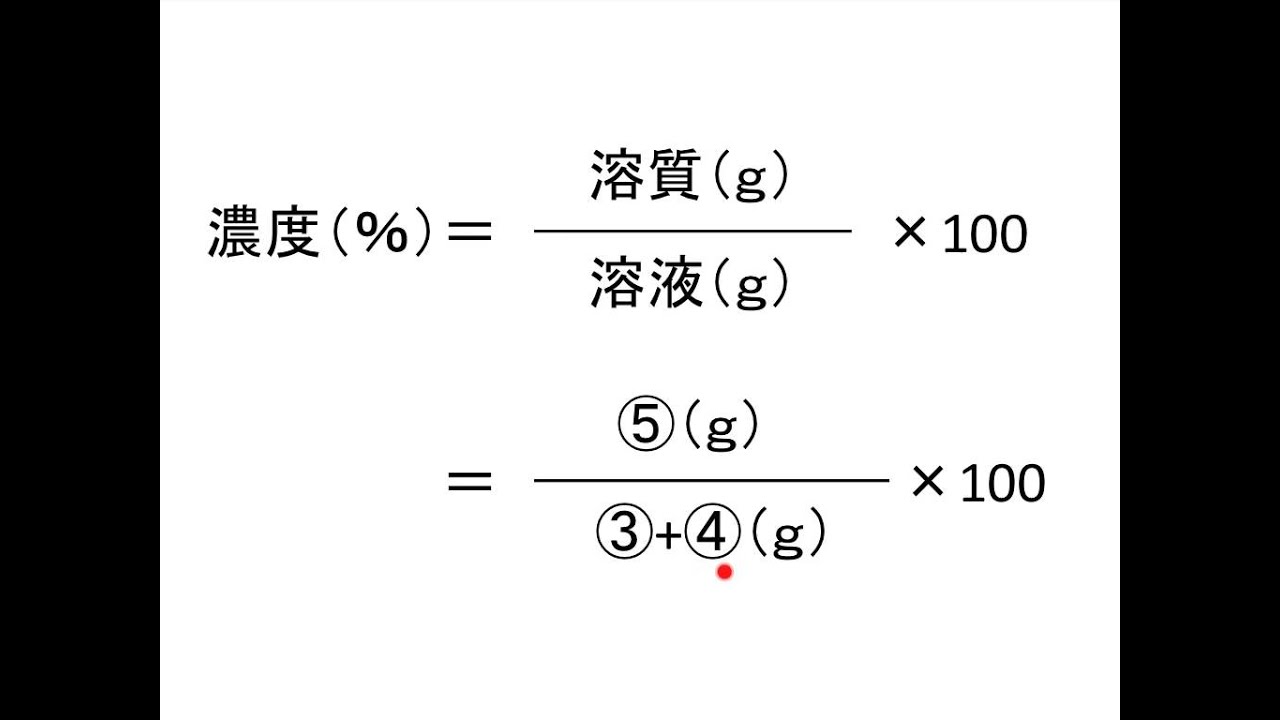
水溶液の濃度(質量パーセント濃度):公式と求め方 水溶液の濃さは溶質の質量を水溶液の質量で割って100をかけて求めます。 溶質の質量÷水溶液の質量×100 この値を質量パーセント濃度ともいいま酸やアルカリの価数をかけたもののイメージです。 X〔mol/L〕×Y〔価〕=X×Y〔N〕 モル濃度〔mol/L〕に 価数を掛けたものが 規定度〔N〕です。 X〔mol/L〕=X×Y〔N〕÷Y〔価〕 X×Y〔N〕÷Y〔価〕= X〔mol/L〕水溶液の性質 (透明性、均 一性)を説明 できる。 溶液中の様子について 粒子モデルで表現し、考 えを交流する。 ・水溶液の濃度を質量パ ーセント濃度で表すこ とができることを知 り、求め方を理解する。 質量パーセン ト濃度を理解 し、その表し 方

質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト
水溶液 濃度 求め方
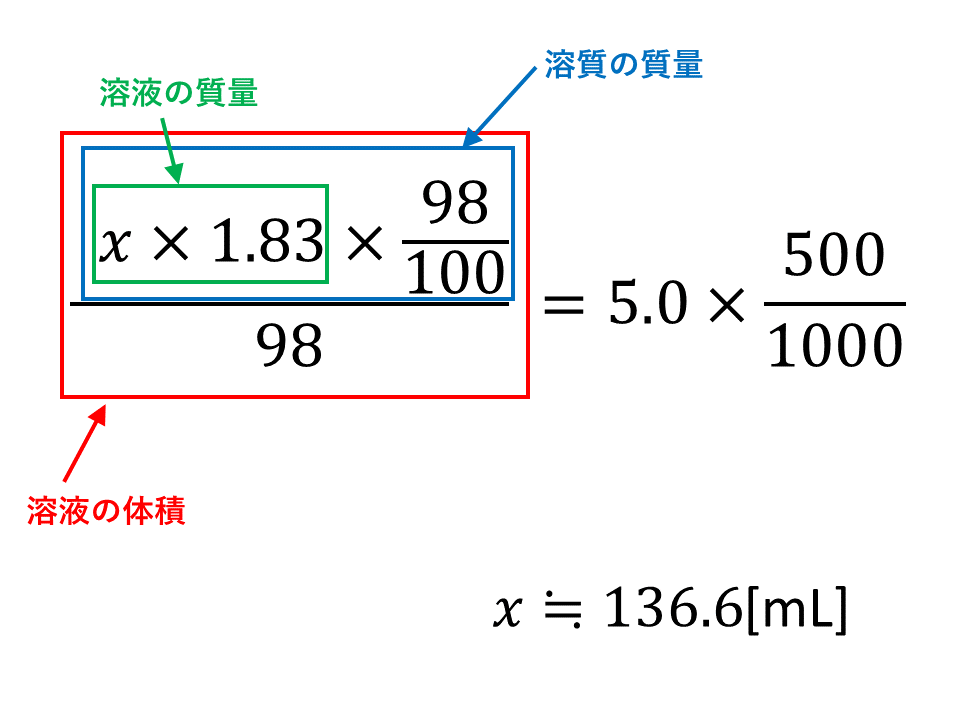
水溶液 濃度 求め方- 中1理科 水溶液の濃度の求め方 食塩水 Youtube 中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで 高校化学 弱酸 酢酸水溶液 の電離度と Ph の求め方 Irohabook 固体の溶解度 化学勉強 040mol/L 硫酸(分子量98)の水溶液の密度は105 g/cm 3 である。この硫酸水溶液の質量パーセント濃度は何%か。 考え方 求めたいのは硫酸水溶液の質量パーセント濃度だから、溶質のグラムと溶液のグラムを求めればok!



溶質を求める
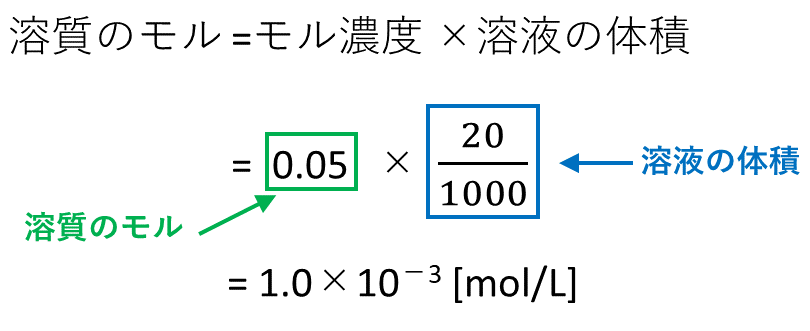
0630 g を水に溶かして100 mL とした水溶液のモル濃度 モル濃度の求め方を押さえ 〔mol=L〕は る。 0630 1260 £ 1000 100 =500£10¡2〔mol=L〕 答 500£10¡2 mol=L 問2 結果1 より,A 液100 mL を中和するのに要したB 液の体 積〔mL〕は 1 回目;927¡024=903〔mL〕 濃度(%)=溶質の質量(g)÷ 溶液の質量(g)×100 $$濃度(%) = \frac{ 溶質の質量(g)}{溶液の質量(g)}×100$$ この式は濃度の求め方の基本ですのでしっかり覚えましょう。 飽和溶液この水溶液のモル濃度を求めましょう。 ただし、原子量 H=10 O=16 Na=23 とします。 (1) まず質量パーセント濃度 (%)から溶質 (g)と溶液 (g) を求めましょう。 質量パーセント濃度 (%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100なので、15 (%)の水酸化ナトリウム溶液は溶液100g中に15gの水酸化ナトリウム(溶質)が溶けていることになります。 今、簡単に溶液
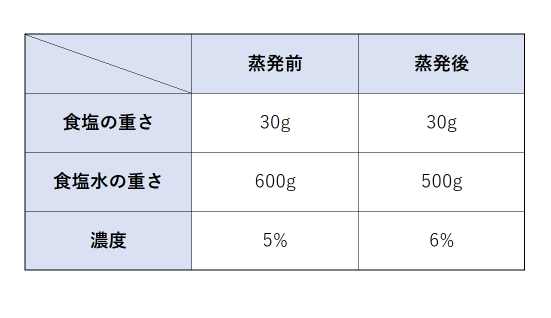
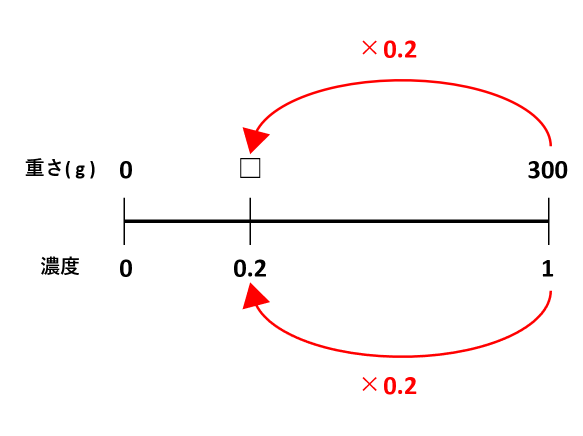
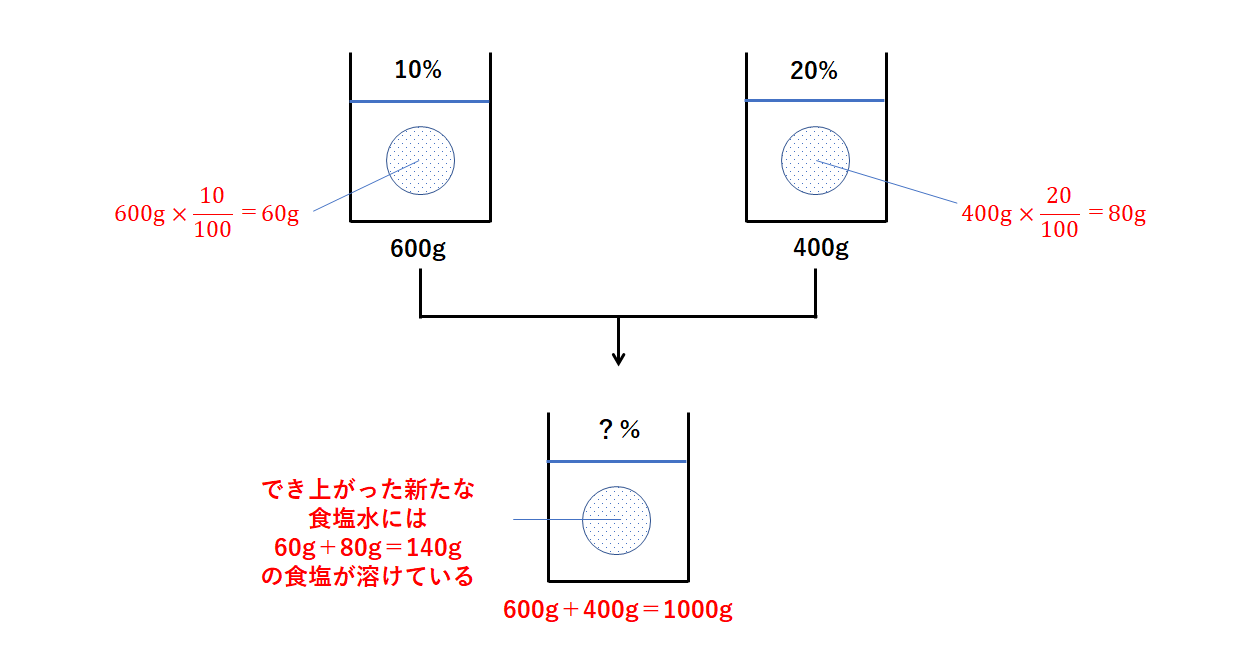
方程式の作り方は,最後にできる食塩水の濃度について式を立て, とします. 12%の食塩水0 (g)には食塩が0×012=24 (g)含まれており,x%の食塩水300gには食塩が300×x÷100=3x (g)含まれているから,これらを混ぜると食塩の合計は 243x (g)になります. また 濃度を対比して求める方法 10%塩化ナトリウム水溶液を02%塩化ナトリウム水溶液にしているので 10÷02=50 50倍に希釈していることになり、もともとの原液の量は1/50であることがこの水溶液500mLを上記の水酸化ナトリウム水溶液で滴定したところ,175mLで中和点に達した。 (1) 水酸化ナトリウム水溶液のモル濃度を求めよ。 (2) 希釈前の食酢中の酢酸のモル濃度を求めよ。 (3) 希釈前の食酢の質量パーセント濃度を求めよ。
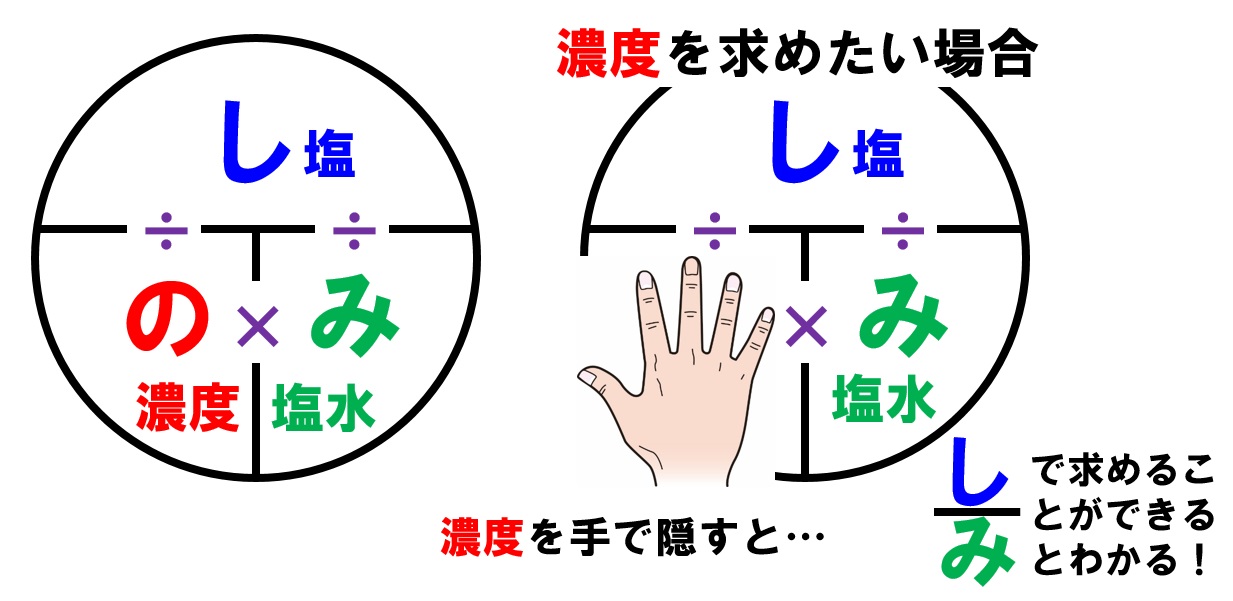
先ほどの濃度を求める式に、 具体的な言葉(=しお)を入れると、 楽な書き方になるんです。 質量パーセント濃度(%) しお (g) しお水 (g) しお(g) しお(g)+水(g) ほら、すごく楽になりま に当てはまる用語を答えよ。 水は電離して1(h )と2(oh – )を生じる。 h_{2}o ⇄ h^{} oh^{} \ 水の電離度は25℃でα=18×109 と極めて3(大きor小さ)いので、電離している水分子はごく僅かである。 また、(反応式の係数から)h とoh – は等量生じるので、水中のh とoh5百万分率濃度(ppm) 定義・説明 ppm parts per millionの略。百万分率。 を1単位として割合をみる場合の「単位」と考えてもよい。 1ppm= =104 % 溶液の濃度をppmで表す場合は、 ppm= 希薄水溶液では、密度を1 g/ml として溶液の質量を求める。 例題5



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
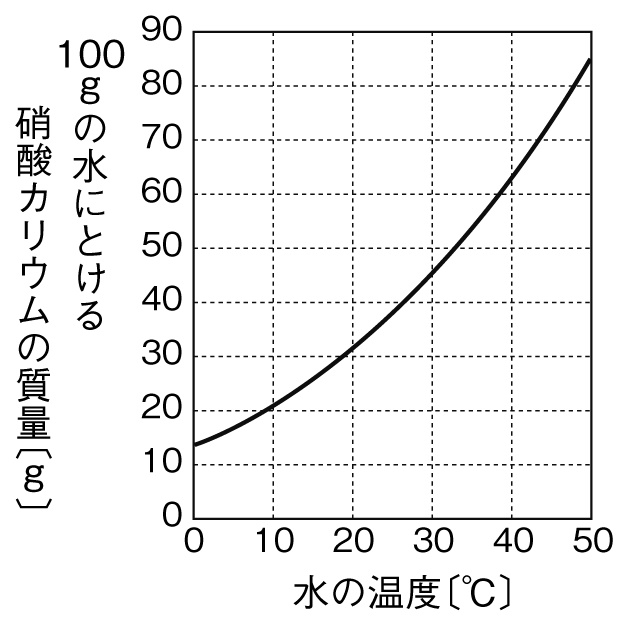
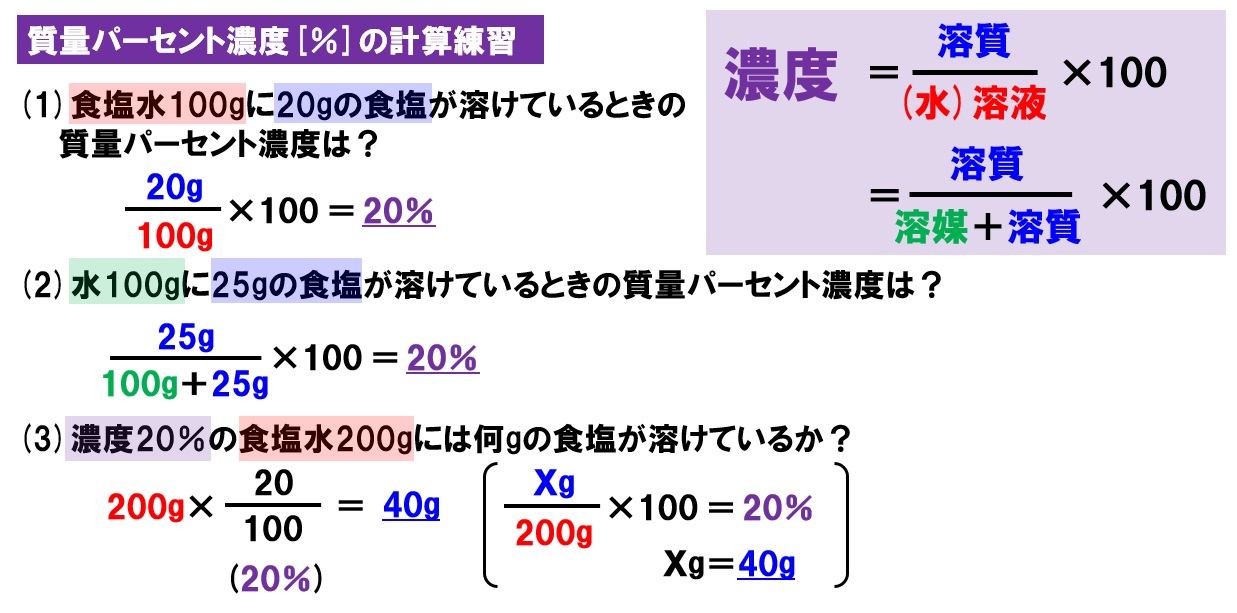
子の観察,実験を行い,水溶液においては溶質が均一 に分散していることを粒子のモデルと関連付けて理解 させることがねらいである.(中略)水溶液の濃さの 表し方に質量パーセント濃度があることにも触れる.」 (文部科学省,08b)と記されている.100gの塩化ナトリウム水溶液になる。 このとき 溶質10g, 溶液(溶媒溶質)100gなので 濃度は 10 100 ×100=10(%) 塩化ナトリウム 100g 90g 10g 水 塩化ナトリウム水溶液 例 100gの水に25gの砂糖を溶かしたときの質量パーセント濃度を求めよ。 答 % 濃度6%の硝酸カリウム 水溶液 濃度 求め 方5百万分率濃度(ppm) 定義・説明 ppm parts per millionの略。百万分率。 を1単位として割合をみる場合の「単位」と考えてもよい。 1ppm= =104 % 溶液の濃度をppmで表す場合は、 ppm= 希薄水溶液では、密度を1 g/ml として溶液の質量を求める。 例題5




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com




溶液の性質 水和水をもつ固体の溶解度の求め方を教えてください 化学 定期テスト対策サイト
簡単公式直角二等辺三角形の面積の2つの求め方 中2数学 159 中2数学証明三角形の内角の和の求め方がわかる3ステップ 中1数学 中1数学平面図形で知っておきたい図形の記号9つのまとめ 緩衝液のpHの計算です。 036mol/L CH3COONa水溶液 酢酸の酸解離定数Ka=18×10^(5)とする。 ハッセルバルク式を使うのかなと思って計算したところ、酢酸の濃度が与えられてないため計算できないという考えに至ったのですがこの問題はどのように解くのでしょうか? 水(濃度の低い方)がデンプン水溶液(濃度の高い方)の方に流れ込み 濃度差を無くそう とする。 このような現象を 浸透 という。 ちなみに、浸透が起こった結果、水の液面は下がりデンプン水溶液の液面は上がっている。



濃度計算の公式はどうして成り立つの 食塩水の問題を割合として理解しよう 中学受験ナビ




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月
質量パーセント濃度の求め方を「溶質」と「溶媒」だけで表すと? 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 2:モル濃度の計算方法・求め方(公式)と単位 モル濃度とは、先ほど解説した通り、「溶液1Lあたりに、どれだけの溶質molが含まれているか?を示したもの」です。 したがって、モル濃度の公式は、 溶質の物質量mol / 溶液の体積L となります。質量/体積(容積)パーセント濃度の求め方 溶質の質量 (g) ÷ 溶液の体積・容積 (ml) × 100 = 質量/体積パーセント濃度 % 体積(容積)ml にしめる、溶質の割合を求める方法です。 質量パーセント濃度は、溶液 100g に占める溶質の割合を求める方法ですが




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun




質量パーセント濃度の計算問題集 基本編 Menon Network
質量パーセント濃度が 22% 、密度が 12g/mL の水酸化ナトリウム水溶液があります。 この水溶液の モル濃度 を求めていきましょう。 さて、どのようにしてモル濃度を求めるか、イメージできますか?ページ 3 / 4 よぉ、桜木建二だ。「濃度の計算」って苦手な人が多いよな。 色々な要素を一つの式にまとめると混乱して間違えやすいが、単位を明記して、一つ一つ順序を守って計算していけば間違えることはないんだ。 今回は「濃度の計算」について、実務でも濃度の計算をしてきた585 gのNaClを含む100 Lの水溶液がある.この水溶液のNaClの濃度 をモル濃度であらわせ.NaClのモル質量は585 g mol1とせよ. 解答 モル濃度を求めるのだから,溶けているNaClが何molなのかを計算して おく必要がある.これをxとして比例計算をする.




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ
(2) 質量パーセント濃度が3%(w/w)の塩化ナトリウム水溶液500 gを調製す るために必要な塩化ナトリウムの質量は何gか計算せよ. (3) 10 %(w/w)の塩化ナトリウム水溶液を水で希釈して,2 %(w/w)の塩化ナト リウム水溶液500 gを調製したい.このとき必要となる10 %(w/w)塩化ナ




濃度の求め方を教えてください Clear



1



濃度計算の公式はどうして成り立つの 食塩水の問題を割合として理解しよう 中学受験ナビ




濃度計算を素早く 化学がちょっとだけ好きな社労士




中学理科 計算問題 質量パーセント濃度の計算 Youtube



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
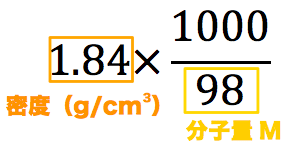



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




この問題の一つ目の モル濃度を求める計算の部分で 1 1 11と 1 1000が何を Clear




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com




高校化学基礎 水素イオン濃度 練習編 映像授業のtry It トライイット




中1理科 濃度の計算 映像授業のtry It トライイット




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン




濃度のはなし 高校生向け モル濃度と質量モル濃度について 学習内容解説ブログ




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com




質量パーセント濃度の計算問題集 基本編 Menon Network




中1理科 水溶液の濃度の求め方 食塩水 Youtube



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee



溶質を求める



濃度の応用



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com



Search Q E8 E9 87 8f 81 Ae E6 B1 81 E6 96 B9 Tbm Isch




質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com



溶液の質量パーセント濃度の求め方と比重を利用した計算問題




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ



Q Tbn And9gcrmko2escnl1cjnurstd0t5dmb X3sdynktao5o9vpdvv4txntd Usqp Cau




水素イオン濃度と水酸化物イオン濃度の求め方計算例題



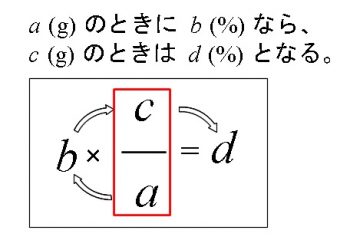
濃度の求め方 絵で覚えよう Youtube




溶液の濃度 無料で使える中学学習プリント



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




4 6 溶液の濃度 おのれー Note




モノマナビ研究所



中1化学 水溶液 濃度 中学理科 ポイントまとめと整理
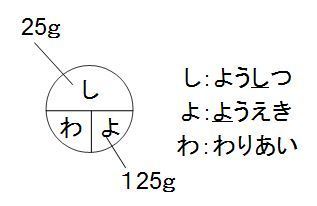



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす




手計算 Excel Phとは 計算方法は




中和滴定による濃度の決定について計算式の意味がわかりません 理科 苦手解決q A 進研ゼミ高校講座




質量パーセント濃度の計算問題集 応用編 Menon Network




理科 中1 27 質量パーセント濃度 Youtube



1




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu



中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋




Science 物質 溶解度と濃度 働きアリ




質量パーセント濃度の求め方とモル濃度の違い




中1 理科 化学 濃度の計算方法 14分 Youtube
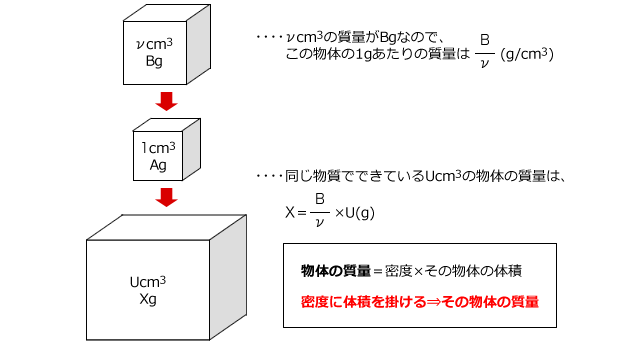



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
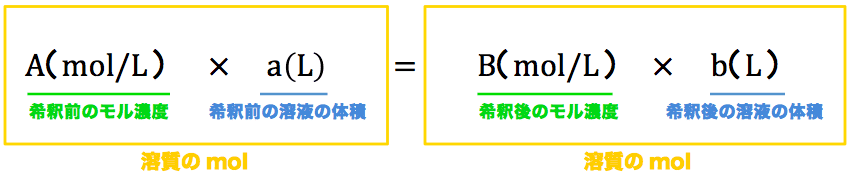



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




1 30g 3100g Descubre Como Resolverlo En Qanda
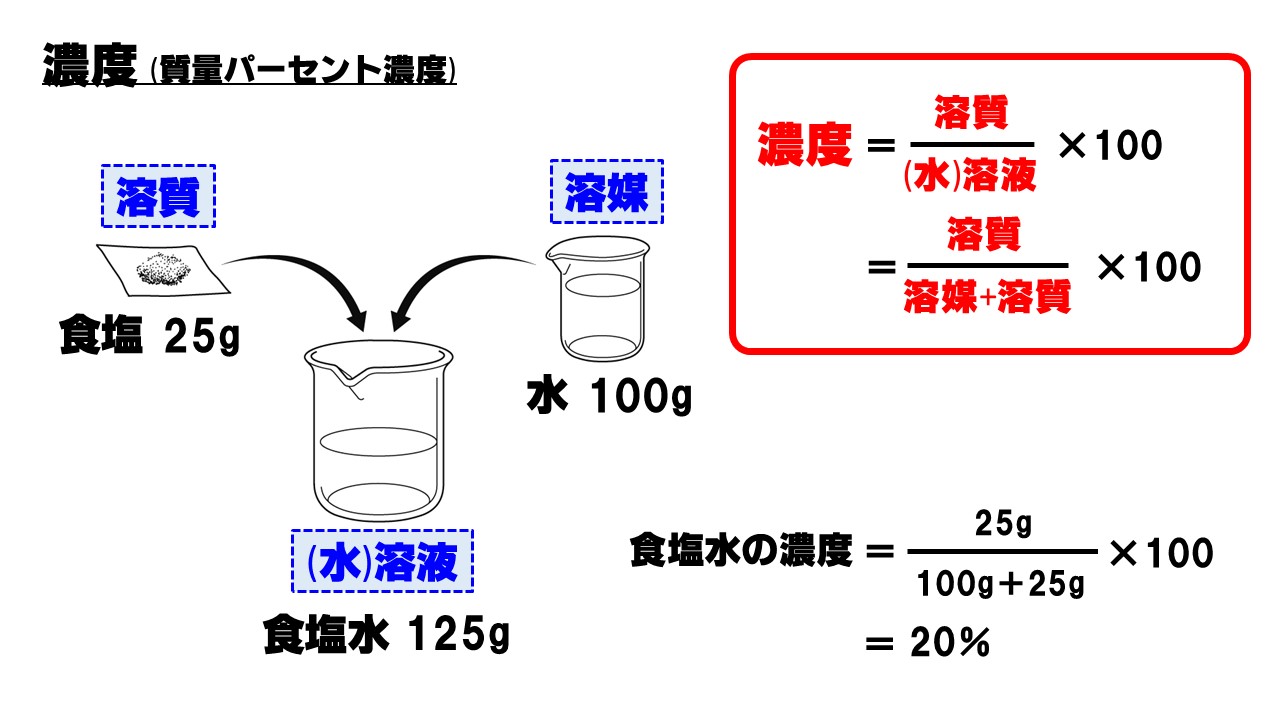



中1理科 濃度 質量パーセント濃度 のポイント Examee



基礎化学3 溶液



Thinkstock Images




見にくくてすいません 化学の質量パーセント濃度計算で Clear



中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす



医療工学科の化学講義 16 溶液濃度計算問題演習 Life Chemistry
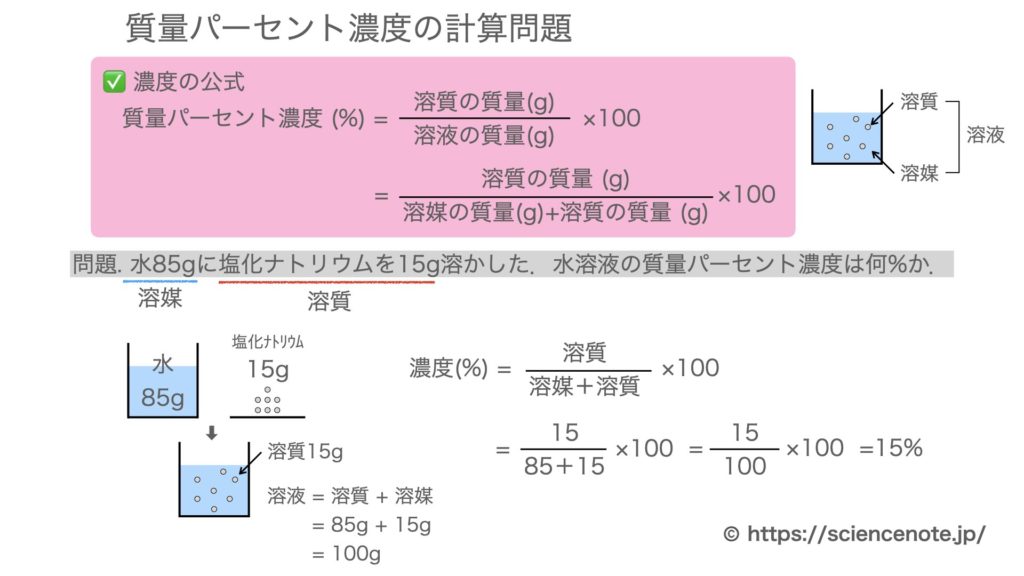



水溶液と質量パーセント濃度の計算問題 Hiromaru Note




溶解度とは 求め方の秘訣 溶解度曲線も図で即理解 計算問題付き 高校生向け受験応援メディア 受験のミカタ




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中学理科 水溶液の濃度と飽和 溶解度 偏差値40プログラマー
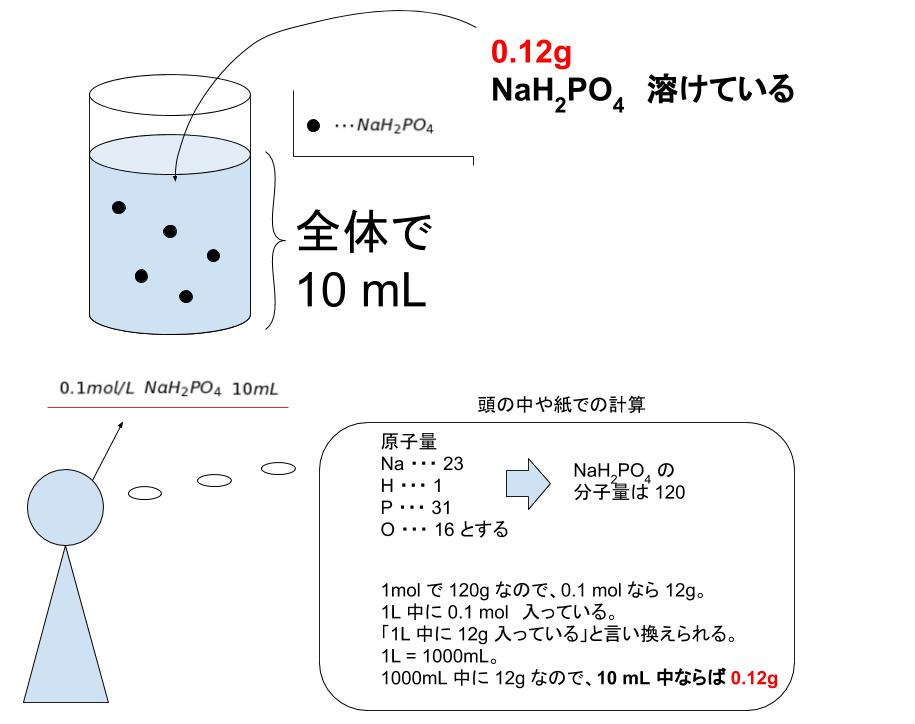



溶液の濃度計算 薬学 これでok




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




溶液の質量パーセント濃度の求め方と比重を利用した計算問題
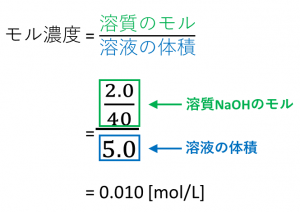



質量 モル 濃度 どうして質量モル濃度なのか Amp Petmd Com
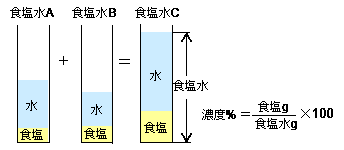



濃度算 混ぜる 高精度計算サイト




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット




高校化学 質量モル濃度 映像授業のtry It トライイット
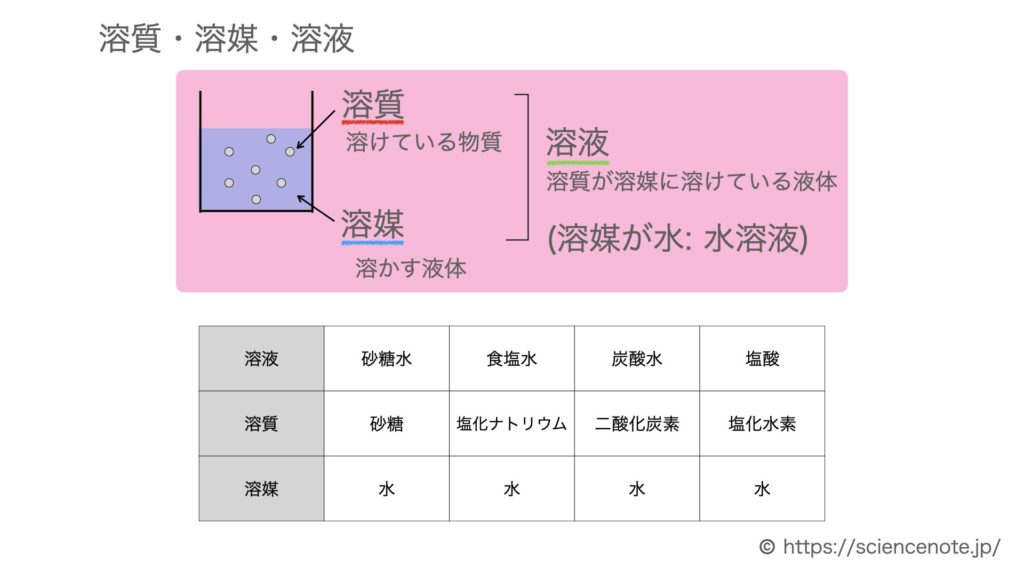



水溶液と質量パーセント濃度の計算問題 Hiromaru Note
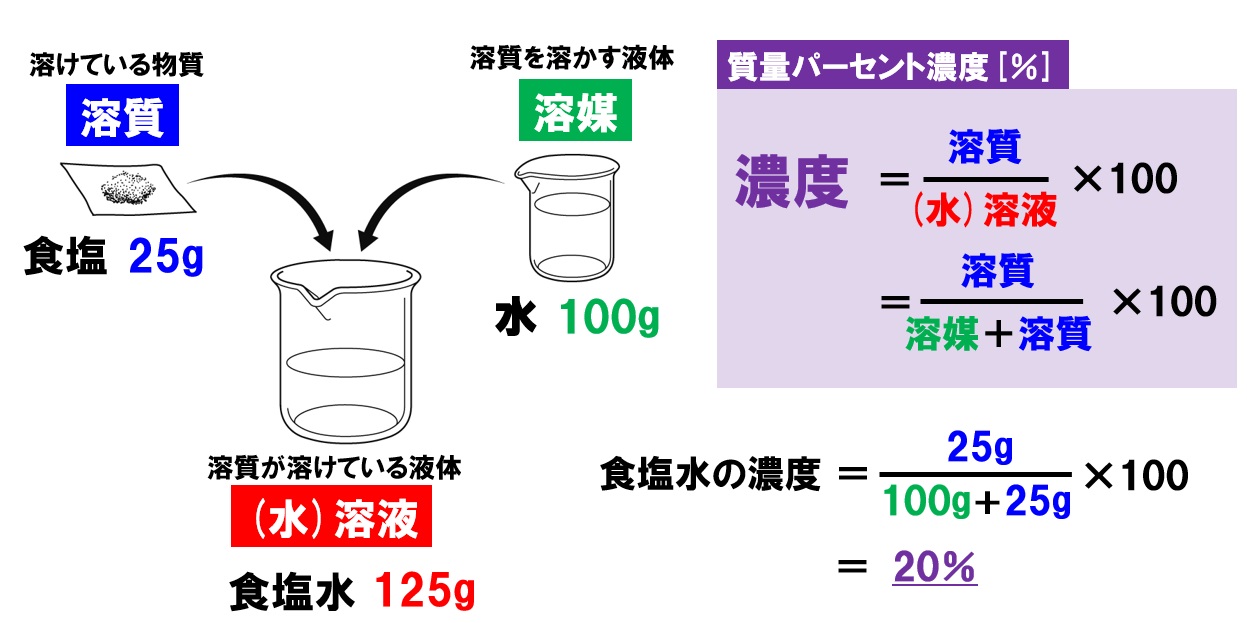



中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu




質量パーセント濃度の計算問題集 基本編 Menon Network
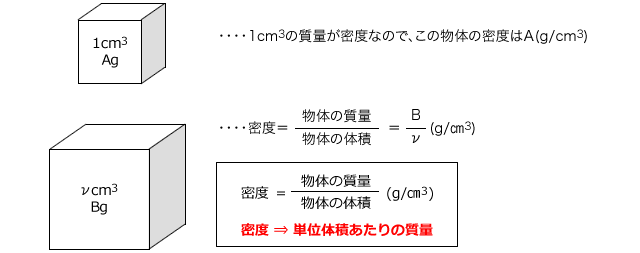



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム
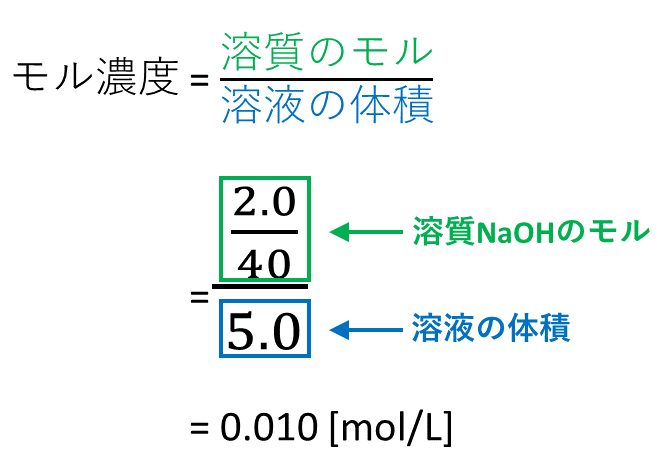



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット




4 6 溶液の濃度 おのれー Note



基礎化学3 溶液




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす



基礎化学3 溶液




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




化学基礎 水素イオン濃度の求め方 Youtube




質量パーセント濃度
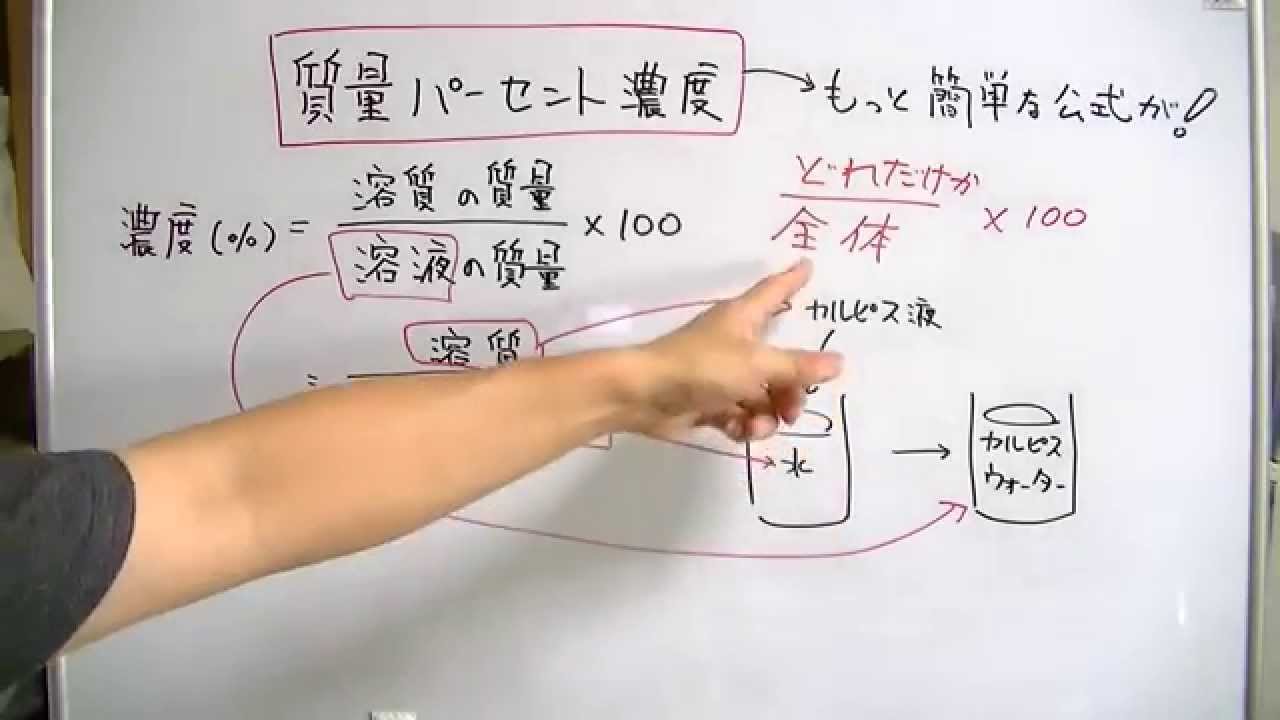



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube




4 6 溶液の濃度 おのれー Note



0 件のコメント:
コメントを投稿